厂商 :武汉纽斯特生物技术有限公司
湖北 武汉- 主营产品:
- 点突变抗体
- 活性试剂盒
- 活性抗体
Monoclonal Anti-cGMP Antibody Based
Direct cGMP ELISA Kit
(New Non-acetylated Version)
Catalog No. 80103
96 Well Kit
产品描述
环磷酸鸟苷(鸟苷-3?,5?-环化一磷酸,cGMP)在许多生理过程中发挥着重要的调控作用。cGMP由鸟苷酸环化酶产生,而被磷酸二酯酶降解,因此激活鸟苷酸环化酶或者抑制磷酸二酯酶可以提高细胞内cGMP的含量。研究发现,cGMP特异性磷酸二酯酶的抑制剂可用于治疗人类疾病,如cGMP特异性磷酸二酯酶第5类型(如伟哥和西力士)可用于治疗勃起功能障碍等疾病。
因此为筛选出腺苷酸环化酶的激活剂或磷酸二酯酶的抑制剂,需要一个高敏感度、特异性的、可重复的方案用于检测cGMP的含量。考虑到大分子的化合物可能存在较弱的影响,这一个初筛是有必要的。
目前商业化提供的一些cGMP ELS Kit检测试剂盒主要使用的是非亲和纯化的cGMP多克隆抗体。尽管据称有特异性,但这些多克隆抗cGMP抗体与cAMP和GTP呈现一定程度的交叉反应。且在大多数细胞类型中,cGMP含量低于cAMP 100倍。
纽斯特生物的cGMP ELS Kit 检测试剂盒使用的是独一无二的鼠单克隆抗cGMP抗体,该单克隆抗cGMP抗体的特异性比cAMP、GTP等类似的小分子高出108 倍以上。相较于其他的多克隆抗体cGMP试剂盒,武汉纽斯特生物cGMP ELS Kit试剂盒能显著的提高其灵敏性和特异性,且能有效避免来自动物多克隆抗体的批次间差异, 因此可以提供长久有效地可重复性定量检测。
此外,其他cGMP ELS Kit试剂盒的多克隆抗cGMP抗体与乙酰化cGMP的亲和力明显高于非乙酰化cGMP,而本试剂盒的单克隆cGMP抗体与乙酰化或非乙酰化cGMP具有同样的亲和力。因此,纽斯特生物cGMP ELISA试剂盒中的样品和标准品不需要乙酰化处理,从而明显缩短了分析时间,有效避免了乙酰化过程中的有机试剂的使用,为大家提供了一个更安全、更健康的工作环境。
工作原理
本试剂盒利用竞争酶联免疫分析方法来测定细胞提取物或体外鸟苷酸环化酶实验中的cGMP的水平。简而言之,将羊抗鼠抗体包被在酶标板上,细胞提取物或体外鸟苷酸环化酶实验中的cGMP与固定数量的偶联辣根过氧化物酶的cGMP竞
争性的结合抗cGMP单克隆抗体,已知的cGMP作为标准品来做标准曲线。经过一段时间孵育,洗掉所有试剂,加入底物进行显色。将多孔板置于酶标仪上,于450nm波长下,进行读数。黄光强度与样品中cGMP的浓度呈反比关系。基于cGMP标准品所得曲线,通过测得的光密度可以计算出样品中cGMP的浓度。
研究背景
cGMP作为独特的第二信使,可调节细胞对各种外源和内源信号分子的反应。 cGMP主要通过激活蛋白激酶、控制特定的离子通道、磷酸二酯酶调节细胞环核苷酸浓度来调节不同的生理过程(8),如血管平滑肌松弛、上皮细胞电解质运输、骨生长、白细胞迁移、轴突引导、精子运动、血小板蔓延以及血管通透性等(1-9)。
通过鸟苷酸环化酶可以实现GTP转化为cGMP。在哺乳动物中,存在2种类型的鸟苷酸环化酶:可溶性及膜结合的鸟苷酸 环化酶(8,10,11)。可溶性环化酶在一氧化氮与血红素辅基结合后,即被激活。七层膜结合鸟苷酸环化酶(即跨膜鸟苷酸环化酶或鸟苷酸环化酶微粒)已被证实存在于人类基因组中,鸟苷酸环化酶A和B是利尿钠肽受体,鸟苷酸环化酶C能被热稳定细菌肠毒素、鸟苷素和脲激活。跨膜鸟苷酸环化酶的活性亦受胞内信号通路的其他受体信号所调控。(12)
试剂盒组成材料
1. 羊抗小鼠IgG包被的96孔微孔板,1张, Catalog No. 30101
该微孔板是将特异性识别小鼠IgG 的山羊抗体包被于可拆分酶标条上
2. cGMP偶联的辣根过氧化物酶, 6mL, Catalog No. 30102
本包装含1000×偶联酶储存液和稀释缓冲液。
注意:为了稳定和长效的实验,抗体储存于-80℃。在使用前将6μL 1000×偶联酶储存液加入到6mL 稀释缓冲液中配制为工作液,并轻轻混匀。工作液请避免反复冻融。
3. cGMP的小鼠单克隆抗体, 6mL, Catalog No. 26001-2
本包装含1000×抗体储存液和稀释缓冲液。
注意:为了稳定和长效的实验,抗体储存于-80℃。在使用前将6μL 1000×抗体加入到6mL 稀释缓冲液中配制为工作液,并轻轻混匀。工作液请避免反复冻融。
4. 中和液, 6mL, Catalog No. 30103
5. 10×浓缩洗涤液, 15mL, Catalog No. 30106
含去污剂的磷酸盐缓冲液。
6. cGMP标准品, 0.25mL, Catalog No. 30114
cGMP浓度5000pmol/ mL
7. 显色底物A,10 mL, Catalog No. 30107
8. 显色底物B, 10mL, Catalog No. 30108
9. 终止液,6mL, Catalog No. 30110
注意:该溶液有腐蚀性;储存时请旋紧瓶盖
试剂盒储存要求
本试剂盒所有组分在有效期限内,于4℃稳定保存。为了长效的实验,1000×储液请保存于-80℃。
本试剂盒未提供的必需试剂
1. 去离子水或蒸馏水。
2. 浓盐酸。
3. 量程在5μL至1000μL之间的精密移液管。
4. 量程为50μL和200μL的中继移液器。
5. 用于稀释储液的一次性烧杯。
6. 刻度量筒。
7. 微孔板振荡器。
8. 吸水纸。
9. 酶标仪,可读波长405nm,在570nm至590nm之间应有修正。
样品处理
该ELISA试剂盒适用于检测经过盐酸处理而终止内源性磷酸二酯酶活性的cGMP样品。这种样品可直接应用于检测,而不需要汽化和进一步的处理。
组织样品 组织样本需预先冰冻于液氮中。在不锈钢研钵中用液氮将组子样本研磨成精细粉末。待液氮挥发完后,称量冰冻组织样本并加入10倍体积的0.1M HCl混匀。室温以大于600g离心力离心,取上层清夜用0.1M HCl稀释至适当浓度。
细胞样品 对于生长的组织培养液中的细胞,首先移除培养基,然后加入0.1M HCl处理细胞。孵育10分钟并观察细胞是否被裂解;如果裂解不充分,接着孵育10分钟并观察。以大于600g离心力于室温离心,收集上清直接用于实验。临用前在0.1M HCl中加入0.1%至1%浓度的Triton-x 100可增强细胞和组织裂解。在这个浓度范围内,去污剂并不干扰试验的结合部位,但是会适度的增加光密度值。含有Triton的样品需利用标准曲线估计浓度,为了最精确的测定,标准曲线需以相同方式稀释。取1 mL细胞培养上清加入10μL浓盐酸,600g离心力于室温离心,
上清液直接用于实验测定培养基中cGMP。
注意步骤
1. 在使用前,将所有试剂放置30分钟,平衡至室温。
2. 用试剂预先润洗枪头在使用;取各种样品、标准品和试剂必需更换枪头。
3. 移取标准品和样品到微孔底部。
4. 从微孔的边缘加入试剂,以避免污染。
5. 该试剂盒使用可拆分的微孔酶标条,使用者可根据样品量多少进行拆分。未使用的酶标条保持干燥,密封于试剂盒提供的铝封袋中,于4℃保存。微孔酶标条需安装在相应的框架上使用。
6. 在加入显色底物前,确保微孔内没有残留的洗涤液。微量残留的洗涤液可能导致分析结果的变化。
试剂准备
1. 非乙酰化cGMP标准品
将5000 pmol/mL cGMP标准品溶液平衡至室温。从#1至#7标记六只洁净试管。移取475μL 0.1M HCl到#1号试管,400μL到#2至#7号试管。加入25μL 5000 pmol/mL cGMP标准品到#1管中,剧烈涡旋震荡。从#1管中取出100μL溶液至#2管中,涡旋震荡。以此类推,重复上步操作,梯度稀释至#7管。
经以上操作,#1至#6管中cGMP标准品浓度分别为250,50,10,2,0.4,0.08和0.016 pmol/mL(详见cGMP加样表)。稀释过的标准品需在30分钟内使用。
标记一只试管作为无标准品空白对照(NSB)。移取600μL 0.1M HCl到NSB管中。
2. 洗涤液
将15 mL 10×洗涤液储液加到135 mL去离子水中,稀释成工作液。稀释液可在室温保存至试剂盒有效期限,或者3个月。
实验步骤
使用前将各种试剂取出放置30分钟,平衡至室温。所有标准品和样品必需设置平行对照实验。
快速加入试剂至样品中,立即漩涡震荡2秒混匀。
1. 依据加样表决定酶标条的使用量,将剩余的酶标条连同干燥剂一起放回密封塑料袋,密封,4℃保存。
2. 移取50μL中和液至各个微孔中,除了TA(总活性)孔和Blank(空白)孔。
3. 移取100μL 0.1M HCl至NSB(非特异结合)孔和B0孔(0 pmol/mL cGMP标准品)。
4. 移取100μL cGMP标准品至相应的孔。
5. 移取100μL样品至相应的孔。
6. 移取50μL 0.1M HCl至NSB(非特异结合)孔。
7. 移取50μL 偶联酶至各孔中,除了TA(总活性)孔和Blank(空白)孔。
8. 移取50μL 抗体工作液至个孔中,除了TA(总活性)孔、Blank(空白)孔和NSB(非特异结合)孔。
9. 将酶标孔置于孔板振动器上,250~500rpm,室温孵育2小时。
10. 在吸水纸上拍干微孔内溶液,加洗涤液400μL每孔洗3次,每次需拍干。
11. 最后一次洗涤,清空各微孔,在干净的无尘吸水纸上轻巧酶标板数次,以确保没有洗涤液残留。
12. 加5μL 偶联酶至TA(总活性)孔。
13. 每孔200μL显色底物溶液,于室温静置5~30分钟。(显色底物A和B需在临用前15分钟内等体积混合,并避光放置。)
14. 每孔加入50μL终止液。终止后立即读数。
15. 清除酶标仪Blank(空白)孔值,读取405nm处的光密度值,在570nm至590nm之间最好有修正。如果酶标仪不能自动清除Blank(空白)孔值,那么手动扣除每个读数的Blank(空白)孔光密度值。
结果计算
样品中cGMP浓度有多种计算方法。X轴表示cGMP标准品浓度,Y轴表示净光密度的平均值或者百分比值。
1. 样品和标准品的净光密度(OD)平均值的计算:
净OD平均值 = OD平均值 - NSB孔OD平均值
2. 计算不同梯度浓度标准品的结合率占最大结合率(B0孔)的百分比,计算公式如下:
百分比值 = (净OD平均值/ B0孔OD平均值)×100
3. 绘制净OD平均值或百分比值对cGMP标准品浓度的Logit-Log曲线。通过插值即可得到样品中cGMP浓度。
标准曲线
下面的曲线不能用于计算cGMP浓度。每次实验需新做一条标准曲线。
(如图)
灵敏度
通过比较10个B0孔平均光密度值(OD)和10个#6管标准品的平均光密度值,计算出灵敏度。cGMP浓度的检测极限通过标准曲线上0位置的两个标准偏差来测定。
阳参平均OD =0.847± 0.0103
5号标准品平均OD=0.729± 0.0013
OD差值 (0-0.08 pmol/mL) =0.118
两倍标准差=0.0206
灵敏度 =(0.0206/0.118)×0.08 pmol/mL =14 fmol/mL
线性关系
cGMP浓度为16.0pmol/mL的样品,用0.1M HCl进行连续七次1:2梯度稀释。将实际的cGMP浓度和测定的cGMP浓度绘制图表。该直线的斜率为1.000,相关系数为0.999。
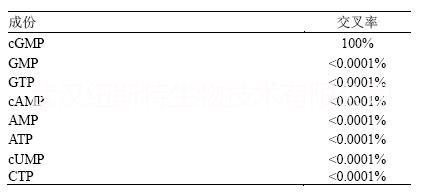
交叉反应
部分相关化合物的交叉反应由竞争ELISA测定。将可能的交叉反应物溶解到试剂盒分析缓冲液中,浓度从500 pmol/mL至500,000 pmol/mL。将这些样品用该试剂盒测定,实测cGMP浓度以50%B/Bo进行计算。交叉反应的%通过比较检测到的交叉反应物浓度和实际的反应物浓度得到,并以百分比的形式表示。
参考文献
1. Estensen, R. D., Hill, H. R., Quie, P. G., Gogan, N., and Goldberg, N. D. (1973) Nature 245, 458-460
2. Elferink, J. G., and VanUffelen, B. E. (1996) Gen Pharmacol 27, 387-393
3. Uemura, Y., and Okamoto, K. (1997) Biochem Mol Biol Int 41, 1085-1092
4. Massberg, S., Sausbier, M., Klatt, P., Bauer, M., Pfeifer, A., Siess, W., Fassler, R., Ruth, P., Krombach, F., and Hofmann, F. (1999) J Exp Med 189, 1255-1264
5. Schmidt, H., Werner, M., Heppenstall, P. A., Henning, M., More, M. I., Kuhbandner, S., Lewin, G. R., Hofmann, F., Feil, R., and Rathjen, F. G. (2002) J Cell Biol 159, 489-498
6. Li, Z., Xi, X., Gu, M., Feil, R., Ye, R. D., Eigenthaler, M., Hofmann, F., and Du, X. (2003) Cell 112, 77-86
7. Manahan, C. L., Iglesias, P. A., Long, Y., and Devreotes, P. N. (2004) Annu Rev Cell Dev Biol 20, 223-253
8. Lucas, K. A., Pitari, G. M., Kazerounian, S., Ruiz-Stewart, I., Park, J., Schulz, S., Chepenik, K. P., and Waldman, S. A. (2000) Pharmacol Rev 52, 375-414
9. Finn, J. T., Grunwald, M. E., and Yau, K. W. (1996) Annu Rev Physiol 58, 395-426
10. Wedel, B., and Garbers, D. (2001) Annu Rev Physiol 63, 215-233
11. Maack, T. (1992) Annu Rev Physiol 54, 11-27
12. Guo, D., Tan, Y. C., Wang, D., Madhusoodanan, K. S., Zheng, Y., Maack, T., Zhang, J. J., and Huang, X. Y. (2007) Cell 128, 341-355









